인증소개
의료기기는 인체에 직접 적용된다는 특성으로 인해 각 국가의 정부기관은 엄격한 기준으로 자국 시장진출을 규제하고 있으며, 미국 또한 FDA를 통해 관리하고 있습니다.
미국에서 의료기기는 FD&C법의 Section 201(h)에서 아래와 같이 정의되어 있으며, 미국에서의 의료기기는 완제품 뿐만 아니라 경우에 따라서는 부속품과 구성품(Accessories and Components)도 의료기기로 취급되고 있다.
"의료기기"란 기계, 기구, 도구, 장치, 삽입물, 체외시약 또는 기타 유사하거나 관련된 물품으로 다음과 같은 모든 부속품 또는 악세서리를 포함한다.
- 공식 국가 처방서, 또는 미국 약전, 또는 그 모두에 관한 변경문서에 기록된 것
- 사용목적이 인간 또는 기타 동물의 질병 또는 기타 상태의 진단, 치료 경감 또는 예방인 것
- 인체 또는 동물의 체내 구조 또는 기능에 영향을 미치는 것으로써 체내 화학작용을 통해, 주요 목적을 이루지 않고 그 목적 달성을 위해 신진 대사 작용에 영향을 받지 않는 것
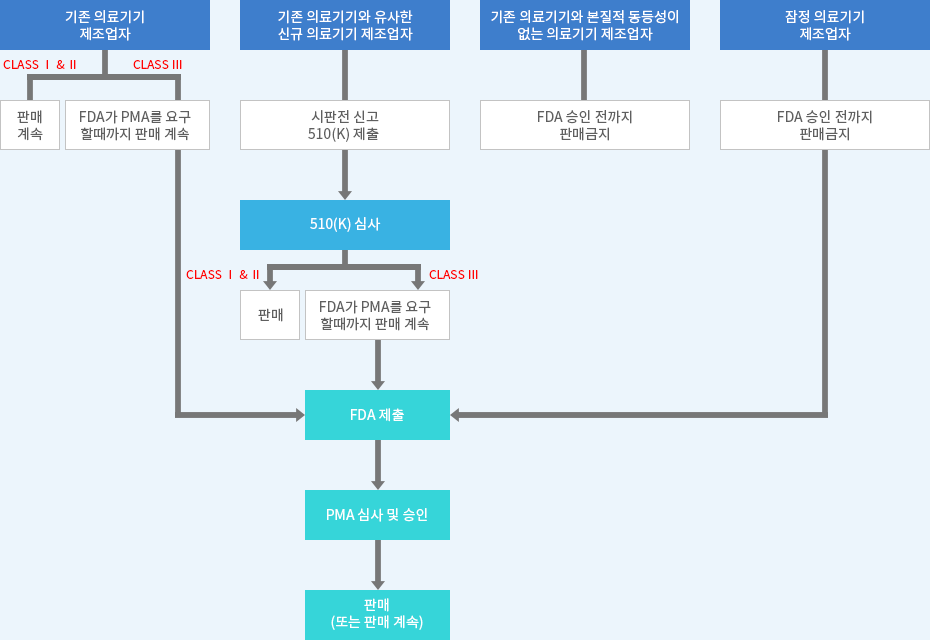
총 3가지 등급 분류
- 1등급 기기(Class Ⅰ) : Registration, Device Listing
- Establishment registration (기업등록)
- Device Listing (제품등록)
- 2등급 기기(Class Ⅱ) : Registration, Device Listing + 510(k) 제출
- 510(k) clearance (PMN - 510(k)인증, 동등성비교, 안전성ᆞ유효성 입증)
- Establishment registration (기업등록)
- Device Listing (제품등록)
- 3등급 기기(Class Ⅲ) : Registration, Device Listing + PMA
- PMA (시판 전 허가, 임상시험적용)
- Establishment registration (기업등록)
- Device Listing (제품등록)
필요성 및 인증의 기대효과
- 미국 시장 진출 시 필수적
- 기업 및 브랜드 이미지 제고
- FDA를 통한 제품의 안전성, 신뢰성 확보
- 새로운 비즈니스 기회의 창출
인증절차
공통 요구사항
- 공장 및 시설등록(Establishment Registration) : Form 2891을 작성하여 제출
FDA 에서는 미국 내 뿐만 아니라 외국 제조업자에게도 해외공장이나 시설등록을 의무화합니다. - 해외 제조자들은 미국 내 US Agent를 상주시켜야 하고, US Agent는 제조회사나 제품의 이해 뿐 만 아니라 FDA 법률을 이해함으로써, FDA와의 연락책임을 맡아야 합니다.
- 의료기기등록 (Medical Devices Listing) : Form 2892를 작성 후 제출하며, 의료기기 제조업자는 해당되는 모든 기기를 US Agent를 통해 각각 등록해야 합니다.
※ 미등록 제품은 통관 시 통관 거부되거나 압류됨
| 라벨링(Labeling) | 라벨링 규정은 포장, 설명서, 광고문구 등을 포함하여 제품의 사용방법, 효능, 주의사항 등이 영문으로 자세히 기재되어야 합니다. |
| 통보 및 수리, 교환과 환불 | 제조업자는 부적합한 의료기기 발견 즉시 사용자에게 통보하거나 수리, 교환, 환불의 의무가 있습니다. |
| 기록과 보고 | 제조업자는 의료기기의 품질을 보증하기 위한 시험검사기록 등을 유지하여야 하며, 필요한 경우 해당 사항을 보고할 의무가 있습니다. |
| 의료기기의 제한 | 의료기기의 안전성, 유효성의 합리적 보증이 불가능한 경우 FDA는 해당 의료기기의 판매, 유통, 사용을 제한할 수 있습니다. |
| 등록과 리스트 제출 | 매년 시설등록, 유통하는 의료기기의 리스트 제출의 의무가 있습니다. |

글로벌표준인증원은 실시간으로 대응 가능한 미국 FDA U.S Agent를 통해 미국 FDA 의료기기 제조 또는 수출 인허가에 대하여 고객의 요구와 FDA 규제사항을 충족할 수 있도록 최선을 다하겠습니다.